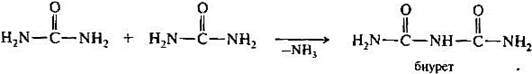О чем статья
Определение, состав и строение белка
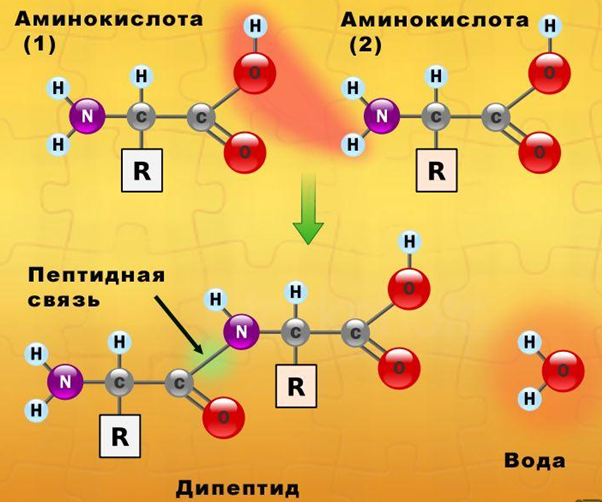
Белки являются биополимерами, мономерами которых являются остатки альфа-аминокислот, соединенные между собой посредством пептидных связей. Аминокислотная последовательность каждого белка строго определена, в живых организмах она зашифрована посредством генетического кода, на основе считывания которого и происходит биосинтез белковых молекул. В построении белков участвует 20 аминокислот.
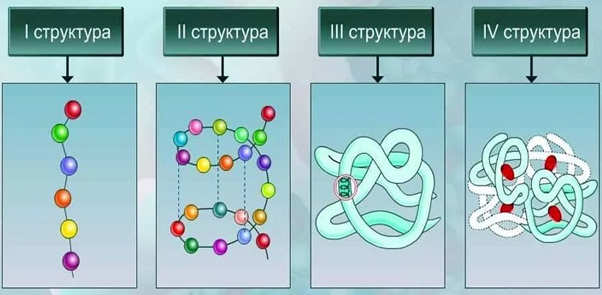
Различают следующие виды структуры белковых молекул:
- Первичная. Представляет собой аминокислотную последовательность в линейной цепи.
- Вторичная. Это более компактная укладка полипептидных цепей при помощи формирования водородных связей между пептидными группами. Есть два варианта вторичной структуры – альфа-спираль и бета-складчатость.
- Третичная. Представляет собой укладку полипептидной цепочки в глобулу. При этом формируются водородные, дисульфидные связи, также стабилизация молекулы реализуется благодаря гидрофобным и ионным взаимодействиям аминокислотных остатков.
- Четвертичная. Белок состоит из нескольких полипептидных цепей, которые взаимодействуют между собой посредством нековалентных связей.
Таким образом, соединенные в определенной последовательности аминокислоты образуют полипептидную цепь, отдельные части которой сворачиваются в спираль или формируют складки. Такие элементы вторичной структур образуют глобулы, формируя третичную структуру белка. Отдельные глобулы взаимодействуют между собой, образуя сложные белковые комплексы с четвертичной структурой.
Классификация белков
Существует несколько критериев, по которым можно классифицировать белковые соединения. По составу различают простые и сложные белки. Сложные белковые вещества содержат в своем составе неаминокислотные группы, химическая природа которых может быть различной. В зависимости от этого выделяют:
- гликопротеины;
- липопротеины;
- нуклеопротеины;
- металлопротеиды;
- фосфопротеины;
- хромопротеиды.
Также существует классификация по общему типу строения:
- фибриллярные;
- глобулярные;
- мембранные.
Протеинами называют простые (однокомпонентные) белки, состоящие лишь из остатков аминокислот. В зависимости от растворимости они делятся на следующие группы:
Подобная классификация не совсем точна, ведь согласно последним исследованиям многие простые белки связаны с минимальным количеством небелковых соединений. Так, в состав некоторых протеинов входят пигменты, углеводы, иногда липиды, что делает их больше похожими на сложные белковые молекулы.
Физико-химические свойства белка
Физико-химические свойства белков обусловлены составом и количеством входящих в их молекулы остатков аминокислот. Молекулярные массы полипептидов сильно колеблются: от нескольких тысяч до миллиона и более. Химические свойства белковых молекул разнообразны, включают в себя амфотерность, растворимость, а также способность к денатурации.
Амфотерность
Поскольку в состав белков входят и кислые, и основные аминокислоты, то всегда в составе молекулы будут свободные кислые и свободные основные группы (СОО- и NН3+ соответственно). Заряд определяется соотношением основных и кислых аминокислотных групп. По этой причине белки заряжены “+”, если уменьшается рН, и наоборот, “-”, если рН увеличивается. В случае, когда рН соответствует изоэлектрической точке, белковая молекула будет иметь нулевой заряд. Амфотерность важна для осуществления биологических функций, одной из которых является поддержание уровня рН в крови.
Растворимость
Классификация белков по свойству растворимости уже была приведена выше. Растворимость белковых веществ в воде объясняется двумя факторами:
- заряд и взаимное отталкивание белковых молекул;
- формирование гидратной оболочки вокруг белка – диполи воды взаимодействуют с заряженными группами на внешней части глобулы.
Денатурация
Физико-химическое свойство денатурации представляет собой процесс разрушения вторичной, третичной структуры белковой молекулы под влиянием ряда факторов: температуры, действии спиртов, солей тяжелых металлов, кислот и других химических агентов.
Важно! Первичная структура при денатурации не разрушается.
Химические свойства белков, качественные реакции, уравнения реакций
Химические свойства белков можно рассмотреть на примере реакций их качественного обнаружения. Качественные реакции позволяют определить наличие пептидной группы в соединении:
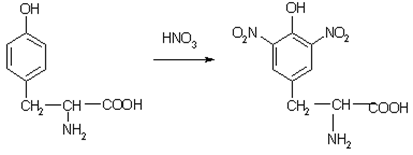
1. Ксантопротеиновая. При действии на белок азотной кислоты высокой концентрации образуется осадок, который при нагревании приобретает желтый цвет.
2. Биуретовая. При действии на слабощелочной раствор белка сульфата меди образуются комплексные соединения между ионами меди и полипептидами, что сопровождается окрашиванием раствора в фиолетово-синий цвет. Реакция используется в клинической практике для определения концентрации белка в сыворотке крови и других биологических жидкостях.
Еще одним важнейшим химическим свойством является обнаружение серы в белковых соединениях. С этой целью щелочной раствор белка нагревают с солями свинца. При этом получают черный осадок, содержащий сульфид свинца.
Биологическое значение белка
Благодаря своим физическим и химическим свойствам белки выполняют большое количество биологических функций, в перечень которых входят:
- каталитическая (белки-ферменты);
- транспортная (гемоглобин);
- структурная (кератин, эластин);
- сократительная (актин, миозин);
- защитная (иммуноглобулины);
- сигнальная (рецепторные молекулы);
- гормональная (инсулин);
- энергетическая.
Белки важны для организма человека, поскольку участвуют в образовании клеток, обеспечивают сокращение мышц у животных, вместе с сывороткой крови переносят многие химические соединения. Помимо этого, белковые молекулы являются источником незаменимых аминокислот и осуществляют защитную функцию, участвуя в выработке антител и формировании иммунитета.
ТОП-10 малоизвестных фактов о белке
- Белки начали изучать с 1728 года, именно тогда итальянец Якопо Бартоломео Беккари выделил белок из муки.
- Сейчас широкое распространение получили рекомбинантные белки. Их синтезируют путем модификации генома бактерий. В частности, таким способом получают инсулин, факторы роста и другие белковые соединения, которые используют в медицине.
- У антарктических рыб были обнаружены белковые молекулы, предотвращающие замерзание крови.
- Белок резилин отличается идеальной эластичностью и является основой мест крепления крыльев насекомых.
- В организме есть уникальные белки шапероны, которые способны восстанавливать корректную нативную третичную или четвертичную структуру других белковых соединений.
- В ядре клетки присутствуют гистоны – белки, которые принимают участие в компактизации хроматина.
- Молекулярную природу антител – особых защитных белков (иммуноглобулинов) – начали активно изучать с 1937 года. Тиселиус и Кабат применяли электрофорез и доказали, что у иммунизированных животных увеличена гамма-фракция, а после абсорбции сыворотки провоцирующим антигеном, распределение белков по фракциям возвращалось к картине интактного животного.
- Яичный белок – яркий пример реализации белковыми молекулами резервной функции.
- В молекуле коллагена каждый третий аминокислотный остаток образован глицином.
- В составе гликопротеинов 15-20% составляют углеводы, а в составе протеогликанов их доля – 80-85%.
Заключение
Белки – сложнейшие соединения, без которых сложно представить жизнедеятельность любого организма. Выделено более 5000 белковых молекул, но каждый индивидуум обладает собственным набором белков и этим отличается от других особей своего вида.